
粤港澳中枢神经再生研究院殷鹏/李晓江团队发表阿尔茨海默病病理研究论文:通过抑制UBE2N清除β-淀粉样蛋白改善阿尔茨海默病病理的新进展
暨南大学融媒体中心讯 7月17日,暨南大学粤港澳中枢神经再生研究院殷鹏/李晓江团队在国际著名经典期刊《阿尔茨海默病与痴呆》Alzheimer's & Dementia(中科院一区,IF=13.0)在线发表题为“Suppressing UBE2N ameliorates Alzheimer’s disease pathology through the clearance of amyloid-β”的研究论文。该研究发现通过抑制UBE2N可清除β-淀粉样蛋白(Aβ)并改善阿尔茨海默病(Alzheimer’s disease,AD)病理,为揭示神经退行性疾病的分子机理及寻找到有效治疗方法提供了思路(论文链接:http://doi.org/10.1002/alz.14122)。

AD的病理特征之一为错误折叠的Aβ沉积形成的淀粉样斑块。其发病原因复杂,衰老则被认为是AD重要诱因之一。这是因为错误折叠的Aβ在衰老过程中逐渐积累,造成神经细胞损伤。这种年龄依赖性的毒性蛋白积累被认为是细胞清除错误折叠蛋白能力受损的结果。细胞可通过泛素化修饰蛋白清除错误折叠蛋白或毒性蛋白,泛素化修饰蛋白然后经泛素-蛋白酶体(UPS)或自噬系统降解。因此,异常的蛋白泛素化可干扰Aβ的清除过程。国内外以往研究提示K63位连接的泛素化修饰异常与错误折叠蛋白Aβ的累积和清除过程密切相关,殷鹏和李晓江团队也曾在衰老的猴脑突触体中发现了年龄依赖性的泛素结合酶(UBE2N)的升高,以及蛋白酶体活性的受损, UBE2N可影响K63位泛素化修饰,导致错误折叠亨廷顿病蛋白的积累 (Yin et al., Hum Mol Genet 2015)。然而,UBE2N对Aβ病理和清除的影响尚不清楚。
在本文中,作者首先比较了AD (5×FAD)小鼠及野生型小鼠海马样本中UBE2N和K63的水平。发现UBE2N在Aβ沉积的AD小鼠中均有所富集。此外,作者通过检测湘雅医学院严小新教授提供的AD患者大脑海马组织,发现在有Aβ沉积的病人脑组织中,UBE2N也有增高。为了证明UBE2N与Aβ的累积相关,作者将AAV载体介导的UBE2N过表达病毒注射到AD小鼠海马中,发现UBE2N的过表达可直接影响AD小鼠在水迷宫、新物体识别、T迷宫等认知行为测试中的表现,并增加Aβ在小鼠脑中的累积。同时,AAV-UBE2N的过表达也使自然衰老的老年食蟹猴脑中的Aβ累积增多。接下来,作者使用CRISPR/Cas9技术或UBE2N小分子抑制剂NSC697923来抑制AD小鼠脑海马区UBE2N的表达。结果显示,UBE2N的敲低可缓解AD小鼠的空间记忆损害,减少Aβ聚集体的累积,及增加K48泛素化水平及蛋白酶体活性。
综上所述,AD小鼠和AD患者大脑中UBE2N水平升高,UBE2N的过表达可加剧AD小鼠和自然衰老猴脑中Aβ的沉积和小鼠认知缺陷, 而抑制UBE2N表达可通过泛素蛋白酶体系统来减少Aβ的累积及改善认知功能。因此,作为一个与衰老相关的蛋白,UBE2N介导的K63泛素化在Aβ生成和累积中的病理作用是AD发病机制和防治研究的新靶点。
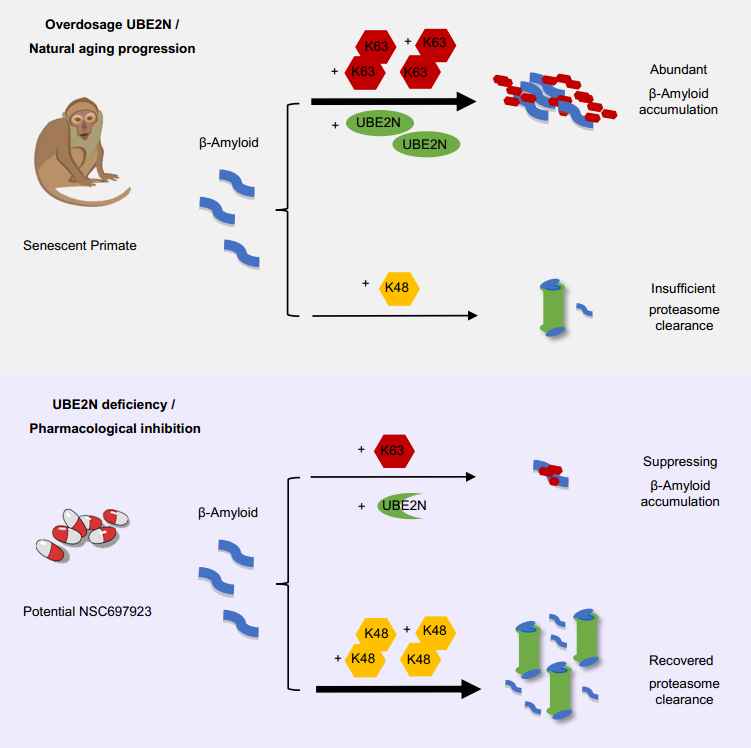
图1.与衰老相关的UBE2N在β-淀粉样蛋白累积及清除机制的示意图。在AD小鼠模型和自然衰老的猴脑中过表达UBE2N可通过K63位泛素化,促进Aβ蛋白的累积。利用CRISPR/Cas9敲低UBE2N或利用其小分子抑制剂NSC697923可通过减少K63位泛素化修饰,来降低脑内Aβ白的积累。
暨南大学的研究生张晨为文章第一作者,贾青青和朱龙洪为共同第一作者,李晓江教授和殷鹏研究员为文章的共同通讯作者。该工作得到了广东省科技厅项目,科技部国家重点研发计划,国家自然科学基金、广东省非人灵长类动物模型研究重点实验室平台的资助。
责编:李伟苗




