
粤港澳中枢神经再生研究院吴政、陈功教授团队为神经再生提供新靶点
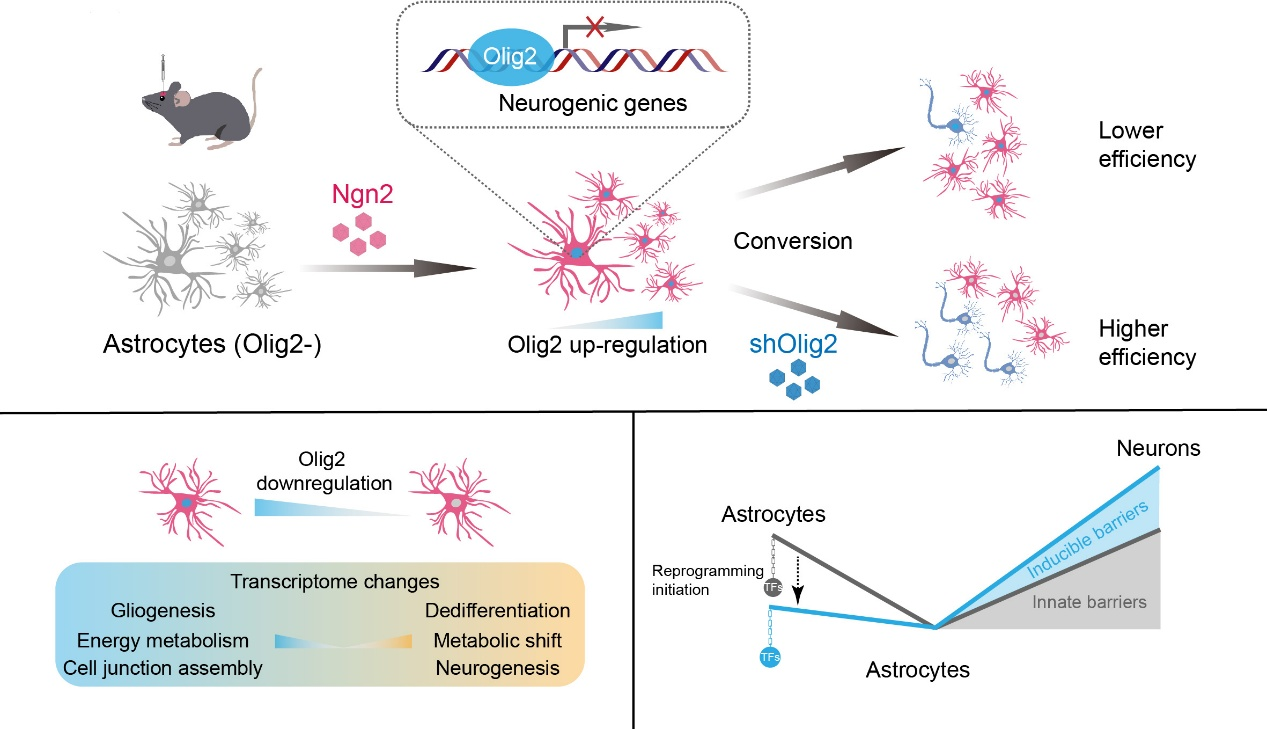
暨南大学融媒体中心讯 近日,暨南大学粤港澳中枢神经再生研究院吴政、陈功教授团队主导的研究发表在《Nature Communications》杂志(IF 15.7)上。该研究首次揭示,在星形胶质细胞启动重编程时,其自身会迅速“激活”一种名为Olig2的转录因子,作为“可诱导屏障”主动抵抗命运转变;降低Olig2能使Ngn2介导的星形胶质细胞向神经元转化效率提升约三倍,并产生具有电生理功能的神经元,为深入理解细胞重编程的阻力机制提供了全新视角,并为提高神经再生治疗效果提供了潜在新靶点。

成年哺乳动物中枢神经系统的再生能力有限,神经元损伤后难以自我修复。近年来,将大脑内丰富的星形胶质细胞原位重编程为功能性神经元,成为神经再生领域极具前景的策略。以Ngn2、Ascl1和NeuroD1等为代表的bHLH转录因子是驱动这一“身份转换”的关键先驱因子。然而,部分转录因子体内重编程效率低下,限制了其临床转化应用。目前已知的障碍多属于细胞固有的“先天屏障”,而对于重编程过程中细胞自身是否会“诱导性”产生新屏障,人们知之甚少。
研究团队发现,当利用腺相关病毒(AAV)载体将神经转录因子Ngn2递送至小鼠大脑皮层星形胶质细胞,启动重编程时,原本在此类细胞中几乎不表达的转录因子Olig2被迅速、强烈地诱导表达。这一现象提示,星形胶质细胞并非被动接受“改造”,而是会主动激活一个抵抗程序。
为了验证Olig2是否就是那道关键的“壁垒”,研究团队设计了精密的实验。他们在递送Ngn2的同时,利用RNA干扰技术干扰星形胶质细胞中的Olig2表达。与仅表达Ngn2的对照组相比,干扰Olig2能将星形胶质细胞转化为神经元的效率提升约三倍。这些新生的神经元不仅数量更多,更在电生理记录中展现出部分成熟的特性,能够产生动作电位,同时约一半的新生神经元能记录到突触电信号,证明部分新生神经元已成功整合入既有的神经环路,具备了行使功能的基础。
通过单细胞测序和CUT&Tag染色质结合分析,团队揭示了Olig2究竟是如何“设卡”的:被诱导表达的Olig2蛋白,会直接结合到包括Ngn2自身基因在内的多个促神经发育基因的调控区域,抑制它们的表达。这形成了一个典型的负反馈回路——外源Ngn2试图启动神经再生程序,却意外“唤醒”了Olig2;而Olig2则反过来抑制Ngn2及其他神经基因的表达,从而为细胞的命运转换踩下“刹车”。
示意图
这项研究的意义在于发现了一种全新的“可诱导型”的重编程屏障。它不同于细胞中预先存在的静态障碍,而是我们在试图改变其命运时,被实时激活的动态防御机制。这就像细胞拥有一个可塑性的“身份保护程序”,而Olig2是其中的关键一环。
本研究受到广东省自然科学基金面上、广州市脑科学与类脑智能关键技术和暨南大学青年PI支持项目等资助。
全文链接:https://doi.org/10.1038/s41467-026-68869-4
责编:常凯丽




